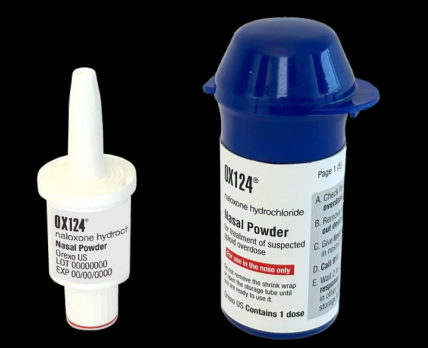
FDA відхилило заявку компанії на схвалення назального засобу OX124, призначеного для стабілізації стану людей, що потерпають від передозуванні опіоїдами.
Агентство надіслало виробнику листа, в якому повідомило, що для повторної подачі заявки йому потрібно провести додаткове дослідження суб’єктивного фактору та надати технічні дані про кінцевий комерційний продукт. Проведення додаткових клінічних досліджень регулятор не вимагає.
Діюча речовина OX124 – налоксон – є антагоністом опіоїдних рецепторів, що вже застосовується як опіоїдний «антидот». Для виробництва препарату використовується запатентована технологія доставки налоксону. Усі компоненти у ній перебувають у аморфної формі, що забезпечує швидке всмоктування через слизову.
Розгляд заявки після повторної подачі фармрегулятору може тривати до шести місяців.
«Ми, як і раніше, впевнені, що наш потужний препарат OX124, який рятує життя, може сприяти зниженню кількості американців, які помирають від передозування, викликаного все більш поширеними синтетичними опіоїдами», — прокоментував рішення регулятора президент та генеральний директор компанії Orexo Ніколай Серенсен (Nikolaj Sørensen).